Medikamententests an Menschen? Das mag gruselig klingen, in der Regel sind solche Untersuchungen jedoch vollkommen harmlos.
Notwendig sind klinische Studien vor allem für die Arzneimittelforschung. Bevor ein neues Medikament oder ein Impfstoff auf den Markt kommt, müssen Wirksamkeit wie auch Nebenwirkungen belegt sein – nicht nur bei Mäusen, auch beim Menschen.
Wer kann bei einer klinischen Studie mitmachen?
Die Testteilnehmer werden anhand definierter Kriterien wie Geschlecht, Alter oder Schweregrad der Erkrankung ausgewählt. Gesunde Personen, die an klinischen Tests teilnehmen, werden übrigens als Probanden bezeichnet – kranke nennt man wie im normalen Leben Patienten.
Wie wird der Erfolg definiert?
Ob eine klinische Studie erfolgreich ist, bestimmen sogenannte Endpunkte – unter Fachleuten auch Surrogatmerkmale genannt. Wissenschaftler unterscheiden hier zwischen harten und weichen Endpunkten – die durchaus beide in ein und derselben Studie vorkommen können.
Ethik-Kommission
Bevor eine klinische Studie in Deutschland durchgeführt werden kann, muss eine Ethik-Kommission sie bewilligen. Diese prüft, ob die geplante Studie aus ethischer, medizinischer und rechtlicher Sicht durchgeführt werden darf. Im Normalfall verfügen medizinische Fakultäten und Landesärztekammern über Ethik-Kommissionen. Ihre Mitglieder werden meistens für vier Jahre gewählt und arbeiten ehrenamtlich.
… die harten Endpunkte
Hier geht es um physikalisch gut messbare Faktoren, wie den Wert des Blutdrucks. Damit klar ist, wann eine Studie das Label „erfolgreich“ verdient, legen die Wissenschaftler vorab genau fest, wie weit sich die Krankheitssymptome, beispielsweise die Nässeln eines Hautausschlags, zurückbilden müssen. Ist das vorgegebene Ziel erreicht, wird das Medikament als wirksam eingestuft.
… die weichen Endpunkte
Neben den harten Fakten können auch Parameter wie die Verbesserung der Lebensqualität, etwa die Minderung von Schmerzen, bewertet werden – was gerade bei unheilbaren Krankheiten wichtig ist. Da solch subjektive Empfindungen schwer quantifizierbar sind, werden diese Merkmale auch als weiche Endpunkte bezeichnet.
Wie ist so eine Studie aufgebaut?
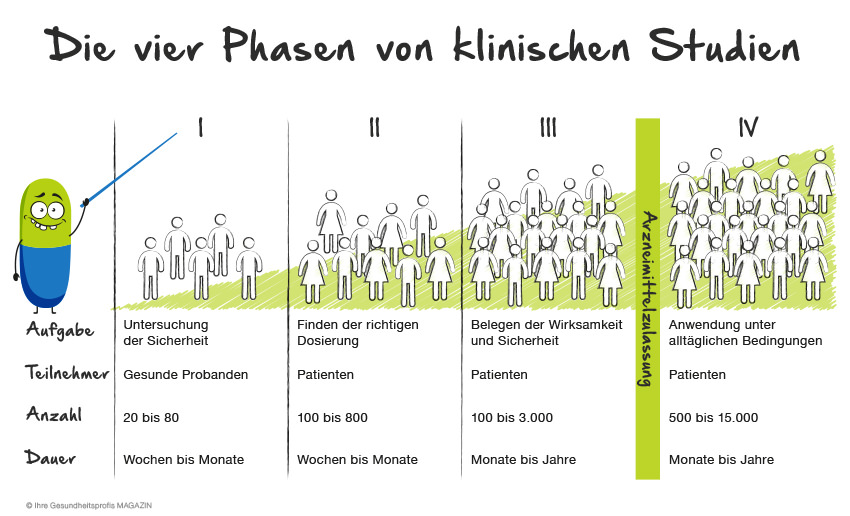
Im Rahmen der Medikamentenzulassung müssen in der Regel vier Phasen durchlaufen werden. Innerhalb der Phasen gibt es unterschiedliche klinische Studien. Sie alle beziehen sich aber auf ein und dasselbe Medikament:
In Phase I prüfen die Wissenschaftler, ob sich ihre Laborannahmen zur Wirksamkeit des Präparats auf den Menschen übertragen lassen. Hierfür wird das Medikament zunächst an gesunden Personen „ausprobiert“ – oft handelt es sich dabei um fitte Männer zwischen 30 und 55 Jahren. Gleichzeitig werden erste Einschätzungen über Art und Höhe der Dosierung getroffen. Soll der Wirkstoff zukünftig als Kapsel geschluckt oder als wasserlösliche Tablette eingenommen werden? Reichen 100 Milligramm pro Tag oder sollten es doch lieber 200 sein? Alles Fragen, die im Laufe der folgenden Studien behandelt werden.
Zulassung für Arzneimittel
Der Antrag auf Medikamentenzulassung muss die Ergebnisse aller klinischen Studien sowie der vorklinischen Tests enthalten. Über eine nationale Zulassung entscheidet das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Im Anschluss bewertet der Gemeinsame Bundesausschuss (G-BA) gemäß dem Gesetzes zur Neuregelung des Arzneimittelmarktes (AMNOG) den Nutzen des neuen Arzneimittels. Auf Grundlage des Ergebnisses handeln Pharmaunternehmen und Krankenkassen gegebenenfalls den Erstattungspreis des Medikamentes aus. Geht es um die Zulassung von Antikörpern, Impfstoffen oder Seren, muss der Antrag beim Paul-Ehrlich-Institut (PEI) gestellt werden.
Für die EU-weite Zulassung ist ein eigenes zentrales Zulassungsverfahren erforderlich. Hierfür wenden sich die Antragsteller an die Europäische Arzneimittel-Agentur (EMA, englisch European Medicines Agency).
Während der Phase II folgt der Test an einer kleinen Gruppe erwachsener Patienten. Idealerweise befinden sie sich in einem Krankheitsstadium, in dem die Arznei die größte Wirkung verspricht. Ziel der Studie ist es zu überprüfen, ob der gewünschte Effekt tatsächlich eintritt. Gleichzeitig werden erste unerwünschte Nebenwirkungen dokumentiert und Höhe und Art der Dosierung werden optimiert.
In der Phase III geht es vor allem um den repräsentativen Nachweis der Unbedenklichkeit. Zu diesem Zweck wird das Medikament an einer größeren und vor allem heterogenen Gruppe getestet (Alter, Geschlecht, Krankheitsgrad etc.). So soll sichergestellt werden, dass möglichst viele Neben- und Wechselwirkungen erkannt werden.
Waren die ersten drei Phasen (I-III) erfolgreich, können die Wissenschaftler einen Antrag auf Medikamentenzulassung stellen. Wird dem zugestimmt, kommt das Arzneimittel auf den Markt und darf in Phase IV unter Alltagsbedingungen getestet werden. Hierfür braucht es Ärzte, die ihren Patienten – sofern diese einverstanden sind! – das neue Arzneimittel verschreiben und eventuelle Neben- und Wechselwirkungen dokumentieren. Solche Anwendungsbeobachtungen sind wichtig, da manche der unerwünschten Nebenwirkungen nur bei einem von 1000 oder einem von 10.000 Patienten auftreten – eine Fallzahl, die keine klinische Studie erreicht.